Die Geheimnisse der spinozerebellären Ataxie Typ 7 entschlüsseln: Wie die Patch-Clamp-Elektrophysiologie Licht auf neuronale Dysfunktionen wirft. Entdecken Sie die neuesten Fortschritte und zukünftigen Richtungen der SCA7-Forschung. (2025)
- Einführung in die spinozerebelläre Ataxie Typ 7 (SCA7)
- Grundlagen der Patch-Clamp-Elektrophysiologie
- Molekulare Pathogenese von SCA7: Ionkanaldysfunktion
- Experimentelle Modelle für elektrophysiologische Studien zu SCA7
- Wichtige Erkenntnisse: Neuronale Erregbarkeit und synaptische Übertragung bei SCA7
- Technologische Innovationen in Patch-Clamp-Techniken
- Klinische Implikationen: Übersetzung der Elektrophysiologie in die Patientenversorgung
- Aktuelle Herausforderungen und Einschränkungen in der SCA7-Elektrophysiologieforschung
- Markt- und Öffentlichkeitsperspektiven: SCA7-Forschung und -Technologie (geschätztes Wachstum von 15 % an öffentlichem und akademischem Interesse bis 2027)
- Zukunftsausblick: Aufkommende Therapien und elektrophysiologische Werkzeuge der nächsten Generation
- Quellen & Referenzen
Einführung in die spinozerebelläre Ataxie Typ 7 (SCA7)
Die spinozerebelläre Ataxie Typ 7 (SCA7) ist eine seltene, autosomal dominante neurodegenerative Erkrankung, die durch fortschreitende zerebelläre Ataxie und Netzhautdegeneration gekennzeichnet ist und letztendlich zu Sehverlust und schweren motorischen Beeinträchtigungen führt. SCA7 wird durch eine CAG-Trinukleotidwiederholungserweiterung im ATXN7-Gen verursacht, die zu einem abnormal langen Polyglutaminabschnitt im Ataxin-7-Protein führt. Diese Mutation führt zu neuronalen Dysfunktionen und Degeneration, die insbesondere Purkinje-Zellen im Kleinhirn und Fotorezeptoren in der Netzhaut betreffen. Stand 2025 bleibt SCA7 unheilbar, wobei die Forschungsanstrengungen darauf gerichtet sind, ihre Pathophysiologie zu verstehen und gezielte Therapien zu entwickeln.
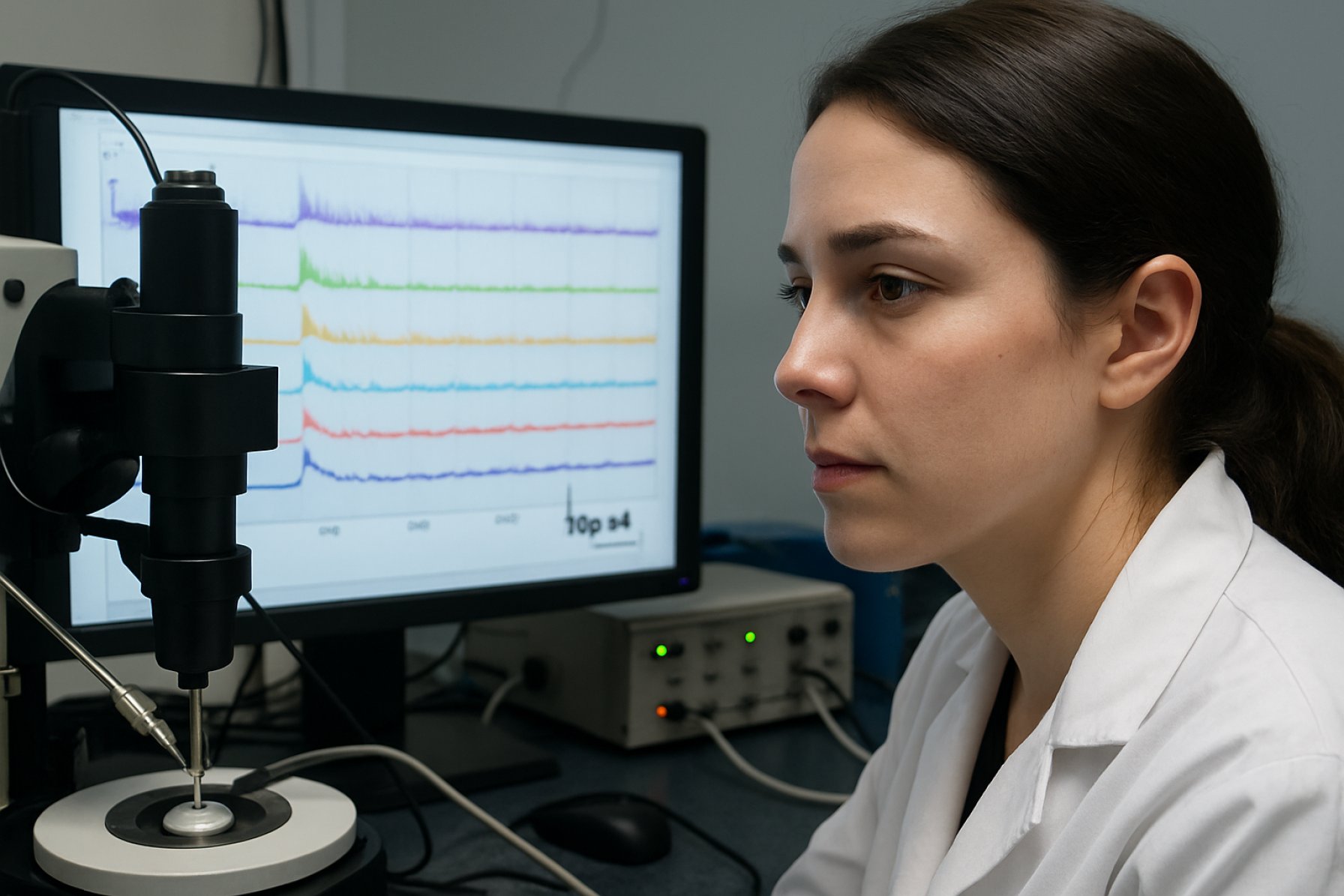
Die Patch-Clamp-Elektrophysiologie hat sich als entscheidende Technik zur Untersuchung der zellulären und molekularen Mechanismen etabliert, die der SCA7 zugrunde liegen. Diese Methode ermöglicht die direkte Messung von Ionenströmen über neuronale Membranen und liefert Einblicke in veränderte neuronale Erregbarkeit, synaptische Übertragung und zugehörige Kanalopathien. In den letzten Jahren haben Fortschritte in der Patch-Clamp-Technologie – einschließlich automatisierter Systeme für Hochdurchsatzuntersuchungen und Integration mit Optogenetik – detailliertere und skalierbare Studien an SCA7-Modellen sowohl in vitro als auch in vivo ermöglicht.
Aktuelle Forschungsarbeiten, wie sie von führenden neurologischen Forschungsinstituten und kollaborativen Konsortien hervorgehoben werden, nutzen die Patch-Clamp-Elektrophysiologie, um die funktionellen Defizite in zerebellären Purkinje-Neuronen zu charakterisieren, die aus iPSC von SCA7-Patienten und transgenen Tiermodellen stammen. Diese Studien haben frühzeitige Veränderungen in der Aktionspotentialfeuerung, der synaptischen Integration und der Kalziumsignalisierung aufgezeigt, die einer offenen Neurodegeneration vorausgehen. Solche Erkenntnisse sind entscheidend, um frühe Biomarker und potenzielle therapeutische Ziele zu identifizieren. Beispielsweise unterstützen die National Institutes of Health und das National Institute of Neurological Disorders and Stroke mehrere Projekte, die Patch-Clamp-Daten nutzen, um den Krankheitsverlauf abzubilden und die Wirksamkeit von Kandidatenmedikamenten zur Wiederherstellung der normalen elektrophysiologischen Funktion zu bewerten.
Wenn wir auf die nächsten Jahre blicken, wird die Integration der Patch-Clamp-Elektrophysiologie mit Einzelzell-Transkriptomik und fortschrittlicher Bildgebung voraussichtlich ein umfassenderes Verständnis der Pathogenese von SCA7 bieten. Internationale Kooperationen, wie sie von der EURORDIS – Rare Diseases Europe koordiniert werden, fördern den Austausch von Daten und die Standardisierung von elektrophysiologischen Protokollen und beschleunigen die Übersetzung grundlegender Forschung in klinische Anwendungen. Während diese Anstrengungen fortgesetzt werden, wird die Patch-Clamp-Elektrophysiologie ein Eckpfeiler im Bestreben bleiben, die Komplexität von SCA7 zu entschlüsseln und wirksame, mechanistisch basierte Therapien zu entwickeln.
Grundlagen der Patch-Clamp-Elektrophysiologie
Die Patch-Clamp-Elektrophysiologie bleibt eine grundlegende Technik zur Untersuchung der zellulären und molekularen Grundlagen neurodegenerativer Erkrankungen wie der spinozerebellären Ataxie Typ 7 (SCA7). Diese Methode ermöglicht die direkte Messung von Ionenströmen über neuronale Membranen und bietet eine unvergleichliche Auflösung der synaptischen und intrinsischen Membraneigenschaften. Im Kontext der SCA7, einer durch polyglutaminreiche Wiederholungen gekennzeichneten Erkrankung, die durch fortschreitende zerebelläre Ataxie und Netzhautdegeneration gekennzeichnet ist, sind Patch-Clamp-Studien entscheidend, um zu erläutern, wie mutiertes Ataxin-7 die neuronale Erregbarkeit und die synaptische Übertragung stört.
In den letzten Jahren hat die Anwendung von Patch-Clamp-Techniken an SCA7-Modellen, insbesondere an genetisch veränderten Mäusen und aus Patienten abgeleiteten iPSC-Neuronen, zugenommen. Diese Ansätze ermöglichen es den Forschern, die elektrophysiologischen Folgen von Ataxin-7-Mutationen auf Einzelzellebene zu untersuchen. Zum Beispiel haben Ganzzellaufzeichnungen von Purkinje-Zellen – den entscheidenden zerebellären Neuronen, die an SCA7 beteiligt sind – veränderte Feuerungsmuster, reduzierte Aktionspotentialfrequenz und beeinträchtigte synaptische Integration offenbart, von denen alle als beitragend für die motorischen Defizite angesehen werden, die bei Patienten beobachtet werden.
Fortschritte bei automatisierten Patch-Clamp-Plattformen werden erwartet, um die Forschung zu SCA7 im Jahr 2025 und darüber hinaus zu beschleunigen. Diese Systeme, die von führenden Organisationen wie Nature und den National Institutes of Health entwickelt wurden, ermöglichen eine höhere Durchsatzrate und Reproduzierbarkeit und machen es möglich, eine große Anzahl von Neuronen oder pharmakologischen Wirkstoffen zu testen. Die Integration von Patch-Clamp-Daten mit transkriptomischen und proteomischen Analysen gewinnt ebenfalls an Bedeutung und bietet eine umfassendere Sicht auf Krankheitsmechanismen und potenzielle therapeutische Ziele.
In den kommenden Jahren wird voraussichtlich eine Verfeinerung der in vitro SCA7-Modelle stattfinden, einschließlich der Verwendung von dreidimensionalen cerebellären Organoiden und Ko-Kultursystemen, die besser die Mikroumgebung der Erkrankung nachstellen. Diese Modelle, kombiniert mit hochmodernen Patch-Clamp-Techniken, ermöglichen die Identifizierung früher elektrophysiologischer Biomarker und die Evaluierung von Kandidatenmedikamenten, die darauf abzielen, die normale neuronale Funktion wiederherzustellen. Kollaborative Bemühungen, die von Organisationen wie den National Institutes of Health und dem National Institute of Neurological Disorders and Stroke geleitet werden, werden voraussichtlich eine entscheidende Rolle dabei spielen, Protokolle zu standardisieren und Daten innerhalb der SCA7-Forschungs-Community auszutauschen.
Zusammenfassend lässt sich sagen, dass die Patch-Clamp-Elektrophysiologie weiterhin ein unverzichtbares Werkzeug in der SCA7-Forschung ist, während laufende technologische und methodologische Innovationen darauf abzielen, unser Verständnis der Pathophysiologie der Erkrankung zu vertiefen und die Entwicklung gezielter Therapien zu beschleunigen.
Molekulare Pathogenese von SCA7: Ionkanaldysfunktion
Die spinozerebelläre Ataxie Typ 7 (SCA7) ist eine fortschreitende neurodegenerative Erkrankung, die durch zerebelläre Ataxie und Netzhautdegeneration gekennzeichnet ist, hauptsächlich verursacht durch CAG-Wiederholungserweiterungen im ATXN7-Gen. Die jüngsten Fortschritte in der Patch-Clamp-Elektrophysiologie haben entscheidende Einblicke in die molekulare Pathogenese von SCA7, insbesondere in Bezug auf die Ionkanaldysfunktion in betroffenen Neuronen, geliefert. Stand 2025 konzentrieren sich die Forschungsanstrengungen zunehmend darauf, die spezifischen Veränderungen in der Ionkanalaktivität zu untersuchen, die neuronale Dysfunktion und Degeneration bei SCA7 zugrunde liegen.
Patch-Clamp-Studien an SCA7-Modellen – von aus Patienten abgeleiteten iPSC-Neuronen bis hin zu transgenen Mausmodellen – haben signifikante Störungen der Funktion von spannungsabhängigen Calcium- und Kaliumkanälen gezeigt. Insbesondere zeigen Purkinje-Zellen im Kleinhirn, die bei SCA7 hochgradig anfällig sind, veränderte Feuerungsmuster und beeinträchtigte Calcium-Homöostase. Diese Veränderungen stehen im Zusammenhang mit abweichender Expression und Funktion von Cav2.1 (P/Q-Typ) Calciumkanälen und Kv3.3 Kaliumkanälen, die beide für das hochfrequente Feuern und die synaptische Integration erforderlich sind, die für die zerebelläre Koordination notwendig sind.
Aktuelle Daten von 2023–2025 heben hervor, dass mutant Ataxin-7-Proteinaggregate die transkriptionale Regulation von Ionkanalgenen stören können, was zu einer reduzierten Kanalausdruck und veränderten biophysikalischen Eigenschaften führt. Zum Beispiel haben Studien, die Ganzzell-Patch-Clamp-Aufzeichnungen verwenden, eine Verringerung der Calcium-Stromdichte und einen erhöhten Aktionspotentialschwellenwert in SCA7-Purkinje-Neuronen gezeigt, was mit den motorischen Defiziten in Tiermodellen korreliert. Diese Erkenntnisse werden durch gemeinsame Forschungsinitiativen unterstützt, die von Organisationen wie den National Institutes of Health und der Muscular Dystrophy Association geleitet werden, die multimodale Studien finanzieren, um die Ionkanaldysfunktion über verschiedene SCA-Subtypen hinweg abzubilden.
In den kommenden Jahren wird erwartet, dass die Integration von hochdurchsatzautomatisierten Patch-Clamp-Plattformen und Einzelzell-Transkriptomik dazu beitragen wird, die molekularen Signaturen der Ionkanaldysregulation in SCA7 weiter zu differenzieren. Diese Ansätze zielen darauf ab, neuartige therapeutische Ziele zu identifizieren, wie Modulatoren spezifischer Calcium- oder Kaliumkanäle, und die Wirksamkeit von Gen-Editing-Strategien zur Wiederherstellung der normalen elektrophysiologischen Funktion zu bewerten. Die National Institutes of Health und internationale Konsortien werden voraussichtlich eine entscheidende Rolle bei der Unterstützung dieser translationalen Bemühungen spielen, mit dem Ziel, Präzisionstherapien zu entwickeln, die die zugrunde liegenden Ionkanalopathien in SCA7 ansprechen.
Experimentelle Modelle für elektrophysiologische Studien zu SCA7
Experimentelle Modelle sind zentral für den Fortschritt der Patch-Clamp-Elektrophysiologiestudien bei der spinozerebellären Ataxie Typ 7 (SCA7), einer neurodegenerativen Erkrankung, die durch fortschreitende zerebelläre Ataxie und Netzhautdegeneration gekennzeichnet ist. Stand 2025 konzentrieren sich die Forschungsanstrengungen zunehmend darauf, sowohl in vitro- als auch in vivo-Modelle zu verfeinern, um den menschlichen Krankheitsphänotyp besser wiederzugeben und hochauflösende elektrophysiologische Untersuchungen zu erleichtern.
Transgene Mausmodelle bleiben der Goldstandard für in vivo SCA7-Forschung. Diese Modelle, die typischerweise erweiterte CAG-Wiederholungen im ATXN7-Gen exprimieren, zeigen charakteristische Merkmale wie die Degeneration von Purkinje-Zellen und motorische Defizite. Jüngste Fortschritte haben die Erzeugung von Knock-in-Mäusen mit patientenspezifischen Wiederholungszahlen ermöglicht, was genauere Krankheitsmodellierungen bietet. Diese Modelle sind besonders wertvoll für Patch-Clamp-Studien, da sie die direkte Messung veränderter synaptischer und intrinsischer Membraneigenschaften in zerebellären Neuronen ermöglichen. Die National Institutes of Health und internationale Konsortien unterstützen weiterhin die Entwicklung und Verbreitung solcher Modelle, um eine breite Zugänglichkeit für die Forschungscommunity sicherzustellen.
Parallel dazu gewinnen aus menschlichen induzierten pluripotenten Stammzellen (iPSCs) abgeleitete Neuronen als ergänzendes in vitro-System an Bedeutung. Die iPSC-Technologie ermöglicht die Ableitung von patientenspezifischen zerebellären Neuronen, einschließlich purkinje-artiger Zellen, die einer Patch-Clamp-Analyse unterzogen werden können, um krankheitsrelevante elektrophysiologische Veränderungen zu bewerten. In den nächsten Jahren werden Verbesserungen in Differenzierungsprotokollen und 3D-Organoidkultursystemen voraussichtlich die Reife und Funktionalität dieser Zellen erhöhen. Initiativen von Organisationen wie dem EuroStemCell-Konsortium beschleunigen die Annahme von iPSC-basierten Modellen für die Forschung über neurodegenerative Erkrankungen, einschließlich SCA7.
Darüber hinaus werden organotypische zerebelläre Schnittkulturen sowohl aus Rodentengewebe als auch aus menschlichem Gewebe optimiert, um langfristige Patch-Clamp-Aufzeichnungen zu ermöglichen. Diese ex vivo-Präparate bewahren native synaptische Schaltkreise, was detaillierte Studien über Netzwerkebene-Dysfunktionen in SCA7 ermöglicht. Die Foundation for the National Institutes of Health und andere Forschungsinstitutionen unterstützen Bemühungen zur Standardisierung dieser Protokolle, um die Reproduzierbarkeit und interlaboratorischen Vergleiche zu verbessern.
In Zukunft wird erwartet, dass die Integration fortschrittlicher genetischer Werkzeuge (z. B. CRISPR/Cas9-vermitteltes Gen-Editing) mit diesen experimentellen Modellen dazu beitragen wird, die Krankheitsmodellierung weiter zu verfeinern und mechanistische Studien zu erleichtern. Die Konvergenz von tierischen, Stammzell- und Organoid-Modellen wird voraussichtlich ein umfassenderes Verständnis der Pathophysiologie von SCA7 auf zellulärer und Netzwerkebene liefern und letztendlich die Entwicklung gezielter Therapien informieren.
Wichtige Erkenntnisse: Neuronale Erregbarkeit und synaptische Übertragung bei SCA7
Jüngste Fortschritte in der Patch-Clamp-Elektrophysiologie haben entscheidende Einblicke in die Pathophysiologie der spinozerebellären Ataxie Typ 7 (SCA7) geliefert, einer fortschreitenden neurodegenerativen Erkrankung, die durch zerebelläre Ataxie und Netzhautdegeneration gekennzeichnet ist. Im Jahr 2025 konzentrieren sich die Forschungsanstrengungen zunehmend darauf, die Veränderungen in der neuronalen Erregbarkeit und der synaptischen Übertragung innerhalb der zerebellären Schaltkreise, insbesondere der Purkinje-Zellen, zu untersuchen, die zentral für die motorische Koordination sind und bei SCA7 besonders anfällig sind.
Wichtige Ergebnisse aus Studien, die sowohl transgene Mausmodelle als auch aus Patienten abgeleitete iPSC-Neuronen verwenden, zeigen, dass SCA7 mit signifikanten Veränderungen in der intrinsischen Erregbarkeit der zerebellären Neuronen verbunden ist. Patch-Clamp-Aufzeichnungen haben eine Verringerung der Feuerfrequenz von Purkinje-Zellen offenbart, oft begleitet von einem erhöhten Aktionspotentialschwellenwert und veränderter Nachhyperpolarisation. Diese Veränderungen werden als Folge der Dysregulation spannungsabhängiger Kalium- und Calciumkanäle sowie einer beeinträchtigten intrazellulären Calcium-Homöostase betrachtet. Solche elektrophysiologischen Signaturen werden nun als frühe Biomarker des Krankheitsverlaufs anerkannt, die einer offenen Neurodegeneration vorausgehen.
In Bezug auf die synaptische Übertragung hebt die aktuelle Datenlage eine Abnahme sowohl der exzitatorischen als auch der inhibitorischen postsynaptischen Ströme in SCA7-Modellen hervor. Diese synaptische Dysfunktion wird auf beeinträchtigte glutamaterge und GABAerge Signalübertragung zurückgeführt, wobei Anzeichen auf eine reduzierte Expression und Funktion von AMPA- und GABAA-Rezeptoren an den synaptischen Stellen hinweisen. Bemerkenswerterweise wurden diese Defizite parallel zu synaptischem Verlust und dendritischer Atrophie beobachtet, was auf eine enge Wechselwirkung zwischen der synaptischen Integrität und der neuronalen Erregbarkeit im Krankheitsprozess hindeutet.
In den kommenden Jahren nutzen laufende Studien Hochdurchsatz-Patch-Clamp-Plattformen und optogenetische Ansätze, um Schaltkreisniveau-Dysfunktionen in SCA7 mit größerer Präzision abzubilden. Es besteht wachsendes Interesse an der Verwendung patientenabgeleiteter iPSC-Modelle zur Validierung von Ergebnissen aus Tierstudien und zur Prüfung der Wirksamkeit von Kandidatentherapeutika, die sich auf Ionkanalfunktion und synaptische Stabilität konzentrieren. Kollaborative Initiativen, wie sie von den National Institutes of Health und dem National Institute of Neurological Disorders and Stroke koordiniert werden, werden voraussichtlich die Umsetzung dieser elektrophysiologischen Erkenntnisse in klinische Biomarker und neuartige Interventionsstrategien in den kommenden Jahren beschleunigen.
Zusammenfassend lässt sich sagen, dass die Patch-Clamp-Elektrophysiologie weiterhin die komplexen Veränderungen in der neuronalen Erregbarkeit und der synaptischen Übertragung aufschlüsselt, die SCA7 zugrunde liegen und eine Grundlage für die Entwicklung von Biomarkern und gezielten Therapien bietet, während das Feld in die Jahre 2025 und darüber hinaus übergeht.
Technologische Innovationen in Patch-Clamp-Techniken
In den letzten Jahren wurden bedeutende technologische Fortschritte in der Patch-Clamp-Elektrophysiologie erzielt, insbesondere in der Anwendung auf die Untersuchung neurodegenerativer Erkrankungen wie der spinozerebellären Ataxie Typ 7 (SCA7). Die Patch-Clamp-Techniken bleiben der Goldstandard zur Untersuchung der Funktion von Ionkanälen und der synaptischen Aktivität auf Einzelzellebene, was kritische Einblicke in die Pathophysiologie von SCA7 liefert. Im Jahr 2025 prägen mehrere Innovationen die Landschaft der SCA7-Forschung, wobei der Schwerpunkt auf erhöhtem Durchsatz, Automatisierung und Integration mit komplementären Technologien liegt.
Automatisierte Patch-Clamp-Systeme sind zunehmend verbreitet und ermöglichen ein Hochdurchsatz-Screening von neuronalen und glialen Zellen, die aus SCA7-patientenspezifischen induzierten pluripotenten Stammzellen (iPSCs) stammen. Diese Plattformen, die von führenden Instrumentierungsunternehmen und Forschungskonsortien entwickelt wurden, ermöglichen die schnelle Bewertung der elektrophysiologischen Eigenschaften großer Zellpopulationen und reduzieren die Variabilität und den Einfluss des Bedieners. Die Integration von Robotik und maschinellen Lernalgorithmen hat die Präzision und Reproduzierbarkeit dieser Messungen weiter verbessert und erleichtert die Identifizierung subtiler elektrophysiologischer Phänotypen, die mit SCA7-Mutationen assoziiert sind.
Eine weitere bemerkenswerte Innovation ist die Entwicklung von hochauflösenden, multisite Patch-Clamp-Arrays. Diese Geräte ermöglichen gleichzeitige Aufzeichnungen von mehreren Neuronen innerhalb cerebellarer Organoide oder Gehirnschnitte, was einen umfassenderen Blick auf die Dysfunktionen auf Netzwerkebene in SCA7 bietet. Solche Ansätze sind besonders wertvoll, um die progressiven synaptischen und schaltkreistechnischen Veränderungen zu dissectieren, die den motorischen und visuellen Defiziten bei SCA7-Patienten zugrunde liegen. Die Übernahme dieser Arrays wird durch kollaborative Bemühungen zwischen akademischen Institutionen, staatlichen Forschungsagenturen und Technologieentwicklern unterstützt, einschließlich Initiativen, die von den National Institutes of Health und der Europäischen Union finanziert werden.
Parallel dazu hat die Kombination der Patch-Clamp-Elektrophysiologie mit fortschrittlichen Bildgebungsverfahren – wie der Zwei-Photonen-Mikroskopie und der Optogenetik – die Echtzeit-Korrelation elektrischer Aktivität mit zellulären und subzellulären Dynamiken in SCA7-Modellen ermöglicht. Dieser multimodale Ansatz beschleunigt die Entdeckung früher Biomarker und therapeutischer Ziele, indem funktionale Defizite mit spezifischen molekularen und strukturellen Veränderungen verknüpft werden.
In den kommenden Jahren wird erwartet, dass die Miniaturisierung und Integration von Patch-Clamp-Plattformen weiter voranschreitet, einschließlich der Nutzung von Mikrofluidik und Nanotechnologie, um Aufzeichnungen von zuvor unzugänglichen Zelltypen und subzellulären Kompartimenten zu ermöglichen. Diese Fortschritte, gekoppelt mit offenen Dateninitiativen und standardisierten Protokollen, die von Organisationen wie den National Institutes of Health gefördert werden, stehen bereit, um kollaborative, großangelegte Studien voranzutreiben, die unser Verständnis der SCA7-Pathogenese vertiefen und die Entwicklung gezielter Interventionen beschleunigen.
Klinische Implikationen: Übersetzung der Elektrophysiologie in die Patientenversorgung
Die Patch-Clamp-Elektrophysiologie hat sich als entscheidende Technik zur Aufklärung der pathophysiologischen Mechanismen der spinozerebellären Ataxie Typ 7 (SCA7) etabliert, einer fortschreitenden neurodegenerativen Erkrankung, die durch zerebelläre Ataxie und Netzhautdegeneration gekennzeichnet ist. Im Jahr 2025 wird die Übersetzung der Patch-Clamp-Funde in die klinische Praxis immer dynamischer, wobei mehrere Forschungsgruppen diese Technologie nutzen, um die Lücke zwischen der Labor- und der Patientenversorgung zu schließen.
Jüngste Studien haben gezeigt, dass Patch-Clamp-Aufzeichnungen aus patientenabgeleiteten induzierten pluripotenten Stammzellen (iPSCs) und cerebellaren Schnitten deutliche Veränderungen in der Ionkanalfunktion und der synaptischen Übertragung in SCA7-Modellen offenbaren. Diese elektrophysiologischen Signaturen werden jetzt mit klinischen Phänotypen korreliert, wie motorischer Inkoordination und visueller Beeinträchtigung, um potenzielle Biomarker für den Krankheitsverlauf und die therapeutische Reaktion zu identifizieren. Zum Beispiel werden abnormale Feuerungsmuster von Purkinje-Zellen, wie sie durch Patch-Clamp nachgewiesen werden, zunehmend als frühe Indikatoren für eine zerebelläre Dysfunktion bei SCA7 anerkannt, was die Bemühungen anführt, diese Erkenntnisse in klinische Studienendpunkte zu integrieren.
Im klinischen Kontext informiert die Integration von Patch-Clamp-Daten die Gestaltung gezielter Interventionen. Die Arzneimittelentwicklung konzentriert sich auf Verbindungen, die spezifische Ionkanäle oder synaptische Proteine modulieren, die an der Pathogenese von SCA7 beteiligt sind. In der frühen Phase klinischer Studien wird erwartet, dass elektrophysiologische Daten als pharmakodynamische Biomarker verwendet werden, um eine genauere Bewertung der Wirksamkeit und der Wirkmechanismen der Medikamente zu ermöglichen. Dieser Ansatz stimmt mit dem breiteren Trend zur personalisierten Medizin überein, bei dem patientenspezifische elektrophysiologische Profile die Therapeutikauswahl und Dosierung leiten können.
Kollaborative Initiativen, wie sie von den National Institutes of Health und dem Euro-ataxia-Patientenvertretungsnetz koordiniert werden, fördern die Standardisierung elektrophysiologischer Protokolle und die Etablierung von multizentrischen Datenbanken. Diese Bemühungen zielen darauf ab, die Validierung von Biomarkern, die aus Patch-Clamp-Daten abgeleitet werden, zu beschleunigen und deren Integration in klinische Studien und die routinemäßige Versorgung zu erleichtern. Darüber hinaus engagieren sich Aufsichtsbehörden, einschließlich der European Medicines Agency, mit den Forschern, um die Beweisstandards zu definieren, die für die Qualifizierung elektrophysiologischer Endpunkte in der Arzneimittelentwicklung für SCA7 erforderlich sind.
Wenn wir in die Zukunft blicken, wird den nächsten Jahren das Auftreten integrierter Diagnoseplattformen erwartet, die Patch-Clamp-Elektrophysiologie mit fortschrittlicher Bildgebung und genetischer Profilierung kombinieren. Solche multimodalen Ansätze versprechen frühere Diagnosen, verbesserte Prognosen und die Entwicklung krankheitsmodifizierender Therapien für SCA7. Während sich das Feld weiterentwickelt, wird eine fortlaufende Zusammenarbeit zwischen Grundlagenforschern, Klinikern und Regulierungsbehörden entscheidend sein, um das klinische Potenzial der Patch-Clamp-Elektrophysiologie in der Patientenversorgung bei SCA7 vollständig zu verwirklichen.
Aktuelle Herausforderungen und Einschränkungen in der SCA7-Elektrophysiologieforschung
Die spinozerebelläre Ataxie Typ 7 (SCA7) ist eine fortschreitende neurodegenerative Erkrankung, die durch zerebelläre Ataxie und Netzhautdegeneration gekennzeichnet ist, deren Pathogenese mit CAG-Wiederholungserweiterungen im ATXN7-Gen verbunden ist. Die Patch-Clamp-Elektrophysiologie bleibt eine grundlegende Technik zur Untersuchung der funktionalen Konsequenzen dieser genetischen Mutationen auf zellulärer Ebene. Allerdings bestehen im Jahr 2025 mehrere erhebliche Herausforderungen und Einschränkungen, die den Fortschritt in der SCA7-Elektrophysiologieforschung behindern.
Eine der Hauptschwierigkeiten ist die Knappheit zuverlässiger menschlicher neuronaler Modelle, die den Krankheitsphänotyp treu wiedergeben. Während aus SCA7-Patienten abgeleitete iPSC-neuronen eine vielversprechende Plattform bieten, kann die Variabilität in Differenzierungsprotokollen und genetischen Hintergründen zu inkonsistenten elektrophysiologischen Ergebnissen führen. Darüber hinaus spiegelt der Reifezustand der iPSC-abgeleiteten Neuronen oft nicht vollständig die Erwachsenenerkrankung von SCA7 wider, was die translational Relevanz der Patch-Clamp-Ergebnisse einschränkt.
Technische Einschränkungen, die der Patch-Clamp-Elektrophysiologie eigen sind, bestehen ebenfalls fort. Die Technik ist arbeitsintensiv, hat eine niedrige Durchsatzrate und erfordert erhebliches Fachwissen, was die Anzahl der Zellen und experimentellen Bedingungen, die analysiert werden können, einschränkt. Dies ist besonders problematisch für SCA7, bei der subtile Veränderungen in der Ionkanalfunktion oder synaptischen Übertragung dem Krankheitsverlauf zugrunde liegen können. Darüber hinaus kann die Fragilität der aus SCA7-Modellen abgeleiteten Neuronen – insbesondere bei jenen mit längeren CAG-Wiederholungen – zu einer schlechten Zelllebensfähigkeit während der Aufzeichnungen führen, was die Datenmengen weiter verringert.
Eine weitere Herausforderung ist das Fehlen standardisierter Protokolle und Referenzdatensätze für Patch-Clamp-Studien zu SCA7. Variabilität in den Aufnahmebedingungen, Zelltypen und Analyseverfahren über Laboratorien hinweg kompliziert den Datenvergleich und die Meta-Analyse. Diese Fragmentierung erschwert die Identifizierung robuster elektrophysiologischer Biomarker für SCA7 und verlangsamt die Entwicklung gezielter Therapien.
In der Zukunft sucht das Feld aktiv nach Lösungen für diese Einschränkungen. Es laufen Bemühungen zur Entwicklung automatisierter Patch-Clamp-Plattformen und physiologisch relevanterer neuronaler Modelle, einschließlich Organoiden und Co-Kultursystemen, die Durchsatz und Krankheitswiedergabe verbessern können. Kollaborative Initiativen, wie sie von den National Institutes of Health und dem Euro-ataxia-Patientenvertretungsnetz koordiniert werden, fördern den Austausch von Daten und die Harmonisierung von Protokollen. Bis diese Fortschritte jedoch weitreichend angenommen werden, wird die Forschung zur SCA7-Patch-Clamp-Elektrophysiologie weiterhin vor erheblichen technischen und biologischen Hürden stehen.
Markt- und Öffentlichkeitsperspektiven: SCA7-Forschung und -Technologie (geschätztes Wachstum von 15 % an öffentlichem und akademischem Interesse bis 2027)
Der Markt und das öffentliche Interesse an der SCA7-Forschung, insbesondere hinsichtlich der Anwendung der Patch-Clamp-Elektrophysiologie, erleben voraussichtlich einen signifikanten Anstieg bis 2027. Dieses Wachstum wird durch eine Konvergenz von Faktoren angetrieben, einschließlich Fortschritten in der Modellierung neurodegenerativer Erkrankungen, gesteigertem Funding für rare Erkrankungen und den erweiterten Möglichkeiten der elektrophysiologischen Technologien. Die Patch-Clamp-Elektrophysiologie bleibt der Goldstandard zur Untersuchung der funktionalen Eigenschaften von Neuronen und synaptischer Übertragung, was sie unverzichtbar zur Aufklärung der Pathophysiologie von SCA7 auf zellulärer Ebene macht.
In den letzten Jahren gab es einen Anstieg der akademischen Veröffentlichungen und Fördermittel für SCA7, wobei Patch-Clamp-Studien entscheidende Einblicke in veränderte Ionkanalfunktionen und synaptische Defizite in Krankheitsmodellen bieten. Die National Institutes of Health (NIH) und die Europäische Union haben die Finanzierung für seltene neurodegenerative Erkrankungen, einschließlich SCA7, in ihren strategischen Forschungsprogrammen priorisiert. Dies hat zur Schaffung von kollaborativen Konsortien und multizentrischen Studien geführt, die voraussichtlich das Tempo der Entdeckung und Technologieübernahme weiter beschleunigen werden.
Im Technologiebereich berichten Unternehmen, die sich auf elektrophysiologische Plattformen spezialisiert haben, wie die Entwicklung automatisierter Patch-Clamp-Systeme, von einer steigenden Nachfrage sowohl aus der akademischen als auch der pharmazeutischen Industrie. Diese Systeme ermöglichen ein Hochdurchsatz-Screening der neuronalen Funktion in SCA7-Modellen und erleichtern die Medikamentenentwicklung und mechanistische Studien. Auch die US-amerikanische Food and Drug Administration (FDA) hat signalisiert, dass sie offen für innovative präklinische Daten, einschließlich elektrophysiologischen Endpunkten, in der Evaluierung neuartiger Therapeutika für seltene Erkrankungen ist.
Das öffentliche Interesse wird voraussichtlich parallel zu den wissenschaftlichen Fortschritten steigen, da Patientenvertretungsgruppen und Organisationen wie das National Institute of Neurological Disorders and Stroke (NINDS) weiterhin das Bewusstsein für SCA7 und die Bedeutung translationaler Forschung erhöhen. Kampagnen in sozialen Medien, Patientenregister und internationale Bewusstseinstage tragen zu einem informierten und engagierten Publikum bei, was wiederum finanzielle Mittel und politische Aufmerksamkeit unterstützt.
Insgesamt zeigt die Prognose für die SCA7-Forschung und die Patch-Clamp-Elektrophysiologie ein robustes Wachstum, mit einer geschätzten Zunahme von 15 % im öffentlichen und akademischen Interesse bis 2027. Dieser Trend wird voraussichtlich durch anhaltende technologische Innovationen, strategische Förderinitiativen und das zunehmende Bewusstsein für den Bedarf an effektiven Therapien für seltene neurodegenerative Erkrankungen unterstützt.
Zukunftsausblick: Aufkommende Therapien und elektrophysiologische Werkzeuge der nächsten Generation
Die Zukunft der Forschung zur spinozerebellären Ataxie Typ 7 (SCA7) steht vor bedeutenden Fortschritten, insbesondere in der Integration der Patch-Clamp-Elektrophysiologie mit aufkommenden therapeutischen Strategien und Technologien der nächsten Generation. Stand 2025 beobachtet das Feld eine Konvergenz hochauflösender elektrophysiologischer Techniken und innovativer molekularer Interventionen, die neue Hoffnung für das Verständnis und die Behandlung dieser devastierenden neurodegenerativen Erkrankung bieten.
Die Patch-Clamp-Elektrophysiologie bleibt der Goldstandard zur Untersuchung der funktionalen Eigenschaften von Neuronen, die von SCA7 betroffen sind, und ermöglicht es den Forschern, Ionkanaldysfunktionen und synaptische Veränderungen auf Einzelzellebene zu untersuchen. In den letzten Jahren hat die Annahme automatisierter Patch-Clamp-Plattformen zugenommen, die den Durchsatz und die Reproduzierbarkeit erhöhen, was es ermöglicht, eine größere Anzahl von patientenabgeleiteten Neuronen und pharmakologischen Verbindungen zu testen. Dies ist besonders relevant, da aus iPSCs abgeleitete Neuronen von SCA7-Patienten zunehmend verwendet werden, um krankheitsspezifische elektrophysiologische Phänotypen in vitro zu modellieren.
In den kommenden Jahren wird die Integration von Patch-Clamp-Daten mit Hochinhaltsbildgebung und Einzelzell-Transkriptomik voraussichtlich ein umfassenderes Verständnis der zellulären und molekularen Grundlagen von SCA7 bieten. Diese multimodalen Ansätze werden wahrscheinlich die Identifizierung neuartiger therapeutischer Ziele und Biomarker beschleunigen. Darüber hinaus ermöglichen die Entwicklung von optogenetischen und chemogenetischen Werkzeugen eine präzise Manipulation der neuronalen Aktivität in SCA7-Modellen, was neue Möglichkeiten für funktionale Rettungsexperimente und Arzneimittel-Screeningin bietet.
Auf therapeutischer Ebene werden Gen-Editing-Technologien wie CRISPR/Cas9 und antisense Oligonukleotide (ASOs) aktiv erforscht, um die zugrunde liegenden genetischen Mutationen in SCA7 zu zielen. Klinische Studien in frühen Phasen und präklinische Studien sind im Gange, wobei elektrophysiologische Daten als kritische Endpunkte zur Bewertung der Wirksamkeit und Sicherheit dienen. Die National Institutes of Health und internationale Konsortien unterstützen kollaborative Bemühungen, um elektrophysiologische Protokolle zu standardisieren und den Datenaustausch zu fördern, was für die Übersetzung von Laborergebnissen in klinische Anwendungen entscheidend sein wird.
In den nächsten Jahren wird voraussichtlich die Technologie von Mikroelektrodenarrays (MEAs) und in vivo Patch-Clamp-Techniken weiterentwickelt, um die Kluft zwischen in vitro Ergebnissen und Patientenergebnissen zu überbrücken. Diese Werkzeuge werden es ermöglichen, langsfristige Überwachungen der neuronalen Netzwerk-Dynamik in Tiermodellen und potenziell in menschlichen Gehirnorganoiden durchzuführen. Während sich das Feld weiterentwickelt, birgt die Synergie zwischen modernster Elektrophysiologie und aufkommenden molekularen Therapien das Potenzial, krankheitsmodifizierende Behandlungen bereitzustellen und die Lebensqualität von Personen mit SCA7 zu verbessern.
Quellen & Referenzen
- National Institutes of Health
- EURORDIS – Rare Diseases Europe
- Nature
- National Institutes of Health
- Muscular Dystrophy Association
- EuroStemCell
- Foundation for the National Institutes of Health
- European Union
- Euro-ataxia
- European Medicines Agency



