Afsløring af mysterierne om Spinocerebellar Ataxia Type 7: Hvordan Patch-Clamp Elektrofysiologi belyser Neuronal Dysfunktion. Opdag de nyeste fremskridt og fremtidige retninger inden for SCA7-forskning. (2025)
- Introduktion til Spinocerebellar Ataxia Type 7 (SCA7)
- Fundamentals of Patch-Clamp Elektrofysiologi
- Molekylær Patogenese af SCA7: Ionkanal Dysfunktion
- Eksperimentelle Modeller til SCA7 Elektrofysiologiske Studier
- Vigtige Fund: Neuronal Eksitabilitet og Syntaktisk Transmission i SCA7
- Teknologiske Innovationer inden for Patch-Clamp Teknikker
- Kliniske Implikationer: Oversættelse af Elektrofysiologi til Patientpleje
- Nuværende Udfordringer og Begrænsninger i SCA7 Elektrofysiologi Forskning
- Markeds- og Offentlighedsinteresse Prognose: SCA7 Forskning og Teknologi (Beregnet 15 % Vækst i Offentlig og Akademisk Opmærksomhed inden 2027)
- Fremtidige Udsigter: Nye Terapier og Næste Generations Elektrofysiologiske Værktøjer
- Kilder & Referencer
Introduktion til Spinocerebellar Ataxia Type 7 (SCA7)
Spinocerebellar Ataxia Type 7 (SCA7) er en sjælden, autosomal dominerende neurodegenerativ lidelse karakteriseret ved progressiv cerebellar ataksi og retinal degeneration, som i sidste ende fører til synstab og svær motorisk nedsættelse. SCA7 skyldes en CAG trinukleotid gentagelsesudvidelse i ATXN7 genet, hvilket resulterer i en unormalt lang polyglutaminsekvens i ataxin-7 proteinet. Denne mutation fører til neuronal dysfunktion og degeneration, som især påvirker Purkinje-cellerne i cerebellum og fotoreceptorerne i retina. Per 2025 er SCA7 stadig uhelbredelig, og forskningsindsatsen fokuserer på at forstå dens patofysiologi og udvikle målrettede terapier.
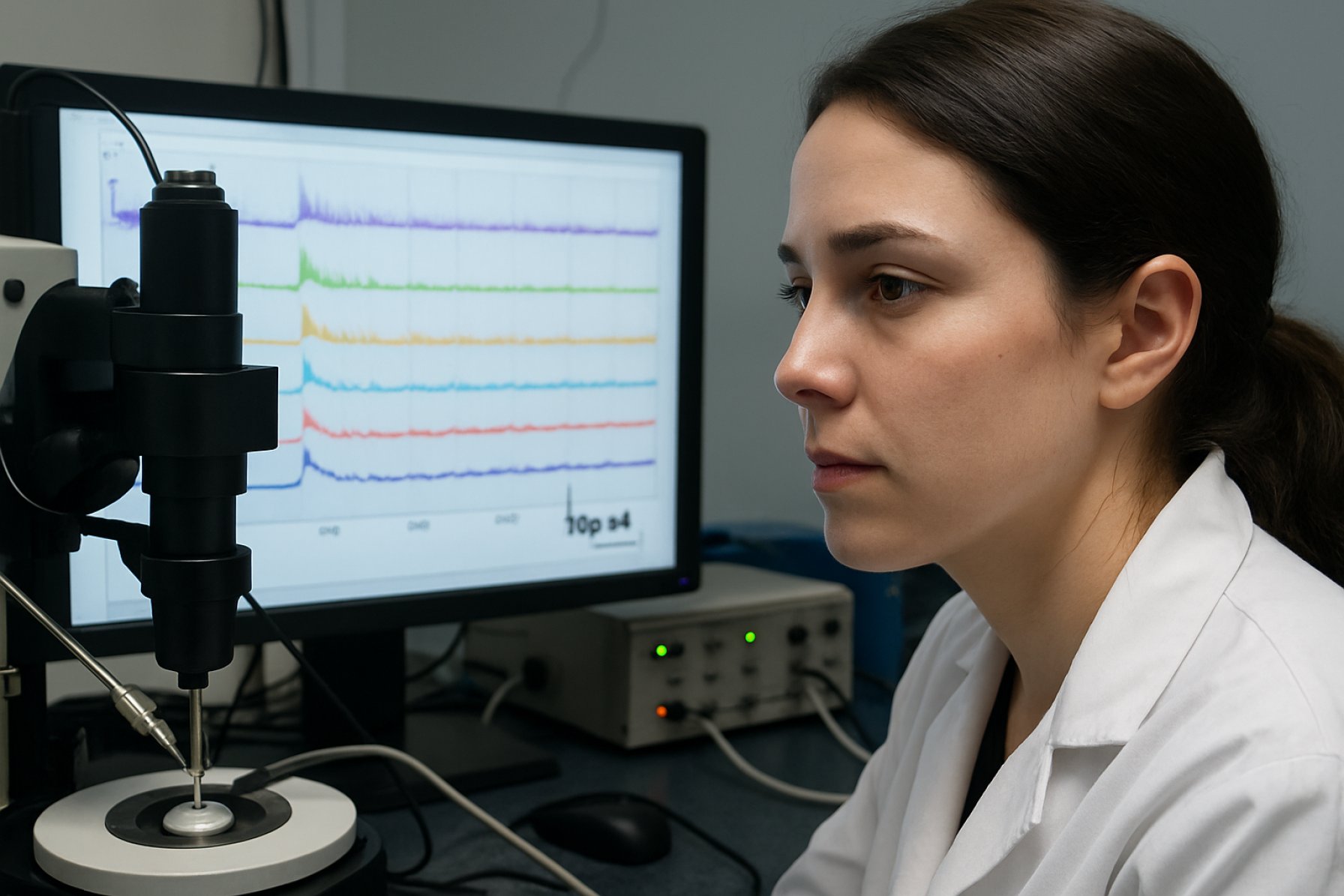
Patch-clamp elektrofysiologi er blevet en kritisk teknik til at undersøge de cellulære og molekylære mekanismer bag SCA7. Denne metode muliggør direkte måling af ioniske strømme over neuronale membraner, hvilket giver indsigt i ændret neuronal excitabilitet, synaptisk transmission og kanalopatier forbundet med sygdommen. I de seneste år har fremskridt i patch-clamp teknologi – herunder højkapacitets automatiserede systemer og integration med optogenetik – muliggjort mere detaljerede og skalerbare studier af SCA7-modeller, både in vitro og in vivo.
Den nuværende forskning, som fremhævet af førende neurologiske forskningsinstitutioner og samarbejdende konsortier, udnytter patch-clamp elektrofysiologi til at karakterisere funktionelle defekter i cerebellære Purkinje-neuroner afledt fra SCA7-patienters inducerede pluripotente stamceller (iPSCs) samt transgene dyremodeller. Disse studier har afsløret tidlige ændringer i aktionspotentialeaffyring, synaptisk integration og calcium-signalering, der forekommer før åbenlys neurodegeneration. Sådanne fund er afgørende for at identificere tidlige biomarkører og potentielle terapeutiske mål. For eksempel støtter National Institutes of Health og National Institute of Neurological Disorders and Stroke flercenterprojekter, der bruger patch-clamp data til at kortlægge sygdomsprogression og evaluere effektiviteten af kandidatlægemidler til at genoprette normal elektrofysiologisk funktion.
Set i lyset af de kommende år forventes integrationen af patch-clamp elektrofysiologi med enkeltcelle-transkriptomik og avanceret billeddannelse at give en mere omfattende forståelse af SCA7 patogenese. Internationale samarbejder, såsom dem, der koordineres af EURORDIS – Rare Diseases Europe, fremmer datadeling og standardisering af elektrofysiologiske protokoller, hvilket fremskynder oversættelsen af grundforskning til kliniske anvendelser. Når disse bestræbelser fortsætter, vil patch-clamp elektrofysiologi forblive en grundpille i jagten på at afdække kompleksiteten af SCA7 og udvikle effektive, mekanismebaserede terapier.
Fundamentals of Patch-Clamp Elektrofysiologi
Patch-clamp elektrofysiologi forbliver en grundlæggende teknik til at undersøge de cellulære og molekylære grundlag for neurodegenerative lidelser som Spinocerebellar Ataxia Type 7 (SCA7). Denne metode muliggør direkte måling af ioniske strømme over neuronale membraner, hvilket giver uovertruffen opløsning af synaptiske og intrinsiske membranegenskaber. I konteksten af SCA7, en polyglutamin-expansion lidelse karakteriseret ved progressiv cerebellar ataksi og retinal degeneration, er patch-clamp studier essentielle for at belyse, hvordan mutant ataxin-7 forstyrrer neuronal excitabilitet og synaptisk transmission.
De seneste år har set en stigning i anvendelsen af patch-clamp teknikker på SCA7-modeller, især i genetisk modificerede mus og patientafledte inducerede pluripotente stamcelle (iPSC) neuroner. Disse tilgange giver forskerne mulighed for at afdække de elektrofysiologiske konsekvenser af ataxin-7 mutationer på enkeltcelle niveau. For eksempel har hele celleoptagelser fra Purkinje-celler – nøglen cerebellære neuroner involveret i SCA7 – afsløret ændrede fyringsmønstre, nedsat aktionspotentialefrekvens og svækket synaptisk integration, alt sammen som menes at bidrage til de motoriske defekter, der observeres hos patienter.
Fremskridt inden for automatiserede patch-clamp platforme forventes at fremskynde SCA7-forskning i 2025 og fremad. Disse systemer, udviklet af førende organisationer som Nature og National Institutes of Health, muliggør højere throughput og reproducerbarhed, hvilket gør det muligt at screene store mængder neuroner eller farmakologiske stoffer. Integrationen af patch-clamp data med transkriptomiske og proteomiske analyser får også et større fremdrift, hvilket giver et mere omfattende billede af sygdomsmekanismer og potentielle terapeutiske mål.
Ser vi fremad, er de næste par år sandsynligvis præget af forfining af in vitro SCA7 modeller, herunder brugen af tredimensionelle cerebellar organoider og co-kultur systemer, der bedre genskaber sygdomsmikroenviromentet. Disse modeller, kombineret med state-of-the-art patch-clamp teknikker, vil lette identifikationen af tidlige elektrofysiologiske biomarkører og evalueringen af kandidatlægemidler, der har til formål at genoprette normal neuronal funktion. Samarbejdsindsatser ledet af organisationer som National Institutes of Health og National Institute of Neurological Disorders and Stroke forventes at spille en afgørende rolle i standardiseringen af protokoller og deling af data på tværs af SCA7 forskningsmiljøet.
Sammenfattende fortsætter patch-clamp elektrofysiologi med at være et uundgåeligt værktøj i SCA7-forskning, med igangværende teknologiske og metodologiske innovationer, der er parate til at uddybe vores forståelse af sygdoms patofysiologi og fremskynde udviklingen af målrettede terapier.
Molekylær Patogenese af SCA7: Ionkanal Dysfunktion
Spinocerebellar Ataxia Type 7 (SCA7) er en progressiv neurodegenerativ lidelse kendetegnet ved cerebellar ataksi og retinal degeneration, primært forårsaget af CAG gentagelsesudvidelser i ATXN7 genet. Nylige fremskridt inden for patch-clamp elektrofysiologi har givet kritiske indsigter i den molekylære patogenese af SCA7, især med hensyn til ionkanal dysfunktion i berørte neuroner. Per 2025 er forskningsindsatsen i stigende grad fokus retter sig mod at afdække de specifikke ændringer i ionkanalaktivitet, der ligger til grund for neuronal dysfunktion og degeneration i SCA7.
Patch-clamp studier i SCA7 modeller – fra patientafledte inducerede pluripotente stamcelle (iPSC) neuroner til transgene musemodeller – har afsløret betydelige forstyrrelser i funktionen af spændingsstyrede calcium- og kaliumkanaler. Især Purkinje-cellerne i cerebellum, der er meget udsatte i SCA7, udviser ændrede fyringsmønstre og svækket calciumhomeostase. Disse ændringer er forbundet med aberrant udtryk og funktion af Cav2.1 (P/Q-type) calciumkanaler og Kv3.3 kaliumkanaler, som begge er essentielle for den høje fyringsfrekvens og synaptisk integration, der kræves for cerebellar koordination.
Nye data fra 2023–2025 fremhæver, at mutant ataxin-7 proteinaggregater kan forstyrre den transkriptionelle regulering af ionkanalgener, hvilket fører til reduceret kanaludtryk og ændrede biofysiske egenskaber. For eksempel har studier ved hjælp af hele celle patch-clamp optagelser demonstreret nedsat calciumstrøm tæthed og øget aktionspotentiale tærskel i SCA7 Purkinje-neuroner, hvilket korrelerer med motoriske defekter observeret i dyremodeller. Disse fund understøttes af samarbejdsforskningsinitiativer ledet af organisationer som National Institutes of Health og Muscular Dystrophy Association, som finansierer flercenterstudier for at kortlægge ionkanal dysfunktion på tværs af forskellige SCA-undergrupper.
Ser vi fremad, forventes de næste par år at se integrationen af højkapacitet automatiserede patch-clamp platforme og enkeltcelle transkriptomics for yderligere at skelne de molekylære signaturer af ionkanal dysregulering i SCA7. Disse tilgange sigter mod at identificere nye terapeutiske mål, såsom modulatorer af specifikke calcium- eller kaliumkanaler, og evaluere effektiviteten af genredigeringsstrategier til at genoprette normal elektrofysiologisk funktion. National Institutes of Health og internationale konsortier forventes at spille en afgørende rolle i at støtte disse oversættelsesindsatser med det mål at udvikle præcisionsbehandlinger, der adresserer de underliggende ionkanalopatier i SCA7.
Eksperimentelle Modeller til SCA7 Elektrofysiologiske Studier
Eksperimentelle modeller er centrale for at fremme patch-clamp elektrofysiologi studier i Spinocerebellar Ataxia Type 7 (SCA7), en neurodegenerativ lidelse, der er kendetegnet ved progressiv cerebellar ataksi og retinal degeneration. Per 2025 er forskningsindsatsen i stigende grad fokuseret på at forfine både in vitro og in vivo modeller for bedre at genskabe den menneskelige sygdomsfenotype og lette undersøgelser af høj opløsning elektrofysiologi.
Transgene musemodeller forbliver guldstandart for in vivo SCA7 forskning. Disse modeller, der typisk udtrykker udvidede CAG gentagelser i ATXN7 genet, udviser karakteristiske træk som degeneration af Purkinje-celler og motoriske defekter. Nylige fremskridt har muliggjort generation af knock-in mus med patient-specifikke gentagelseslængder, hvilket giver en mere præcis sygdomsmodellering. Disse modeller er særligt værdifulde til patch-clamp studier, da de giver mulighed for direkte måling af ændret synaptisk og intrinsisk membranegenskaber i cerebellære neuroner. National Institutes of Health og internationale konsortier fortsætter med at støtte udviklingen og distributionen af sådanne modeller, hvilket sikrer bred tilgængelighed for forskningsmiljøet.
Parallelt er humane inducerede pluripotente stamcelle (iPSC)-afledte neuroner ved at vinde frem som et komplementært in vitro system. iPSC-teknologi muliggør afledning af patient-specifikke cerebellære neuroner, herunder Purkinje-ligende celler, som kan underkastes patch-clamp analyse for at vurdere sygdomsrelevante elektrofysiologiske ændringer. I de kommende år forventes forbedringer i differentieringsprotokoller og 3D organoid kultur systemer at forbedre modenheden og funktionelle relevans af disse celler. Initiativer fra organisationer såsom EuroStemCell konsortiet fremskynder adopteringen af iPSC-baserede modeller til neurodegenerative sygdomsforskning, herunder SCA7.
Derudover optimeres organotypiske cerebellære skiver fra både rodent- og humane væv til langtidsholdbare patch-clamp optagelser. Disse ex vivo forberedelser bevarer de native synaptiske kredsløb, hvilket muliggør detaljerede studier af netværksniveau dysfunktion i SCA7. Foundation for the National Institutes of Health og andre forskningsinstitutioner støtter bestræbelserne på at standardisere disse protokoller med det mål at forbedre reproducerbarheden og tværlaboratorie sammenligninger.
Set i lyset af fremtiden, forventes integrationen af avancerede genetiske værktøjer (f.eks. CRISPR/Cas9 medieret genredigering) med disse eksperimentelle modeller at yderligere forfine sygdomsmodellering og lette mekanistiske studier. Konvergensen af dyremodeller, stamcelle- og organoidmodeller forventes at give en mere omfattende forståelse af SCA7 patofysiologi på cellulært og netværksniveau, hvilket i sidste ende vil informere udviklingen af målrettede terapier.
Vigtige Fund: Neuronal Eksitabilitet og Syntaktisk Transmission i SCA7
Nye fremskridt i patch-clamp elektrofysiologi har givet kritiske indsigter i patofysiologien af Spinocerebellar Ataxia Type 7 (SCA7), en progressiv neurodegenerativ lidelse kendetegnet ved cerebellar ataksi og retinal degeneration. I 2025 har forskningsindsatsen i stigende grad fokuseret på at dissekere ændringer i neuronal excitabilitet og synaptisk transmission inden for cerebellære kredsløb, især Purkinje-celler, som er centrale for motorisk koordinering og er bemærkelsesværdigt sårbare i SCA7.
Vigtige fund fra studier, der bruger både transgene musemodeller og patientafledte inducerede pluripotente stamcelle (iPSC) neuroner, indikerer, at SCA7 er forbundet med betydelige ændringer i den intrinsiske excitabilitet af cerebellære neuroner. Patch-clamp optagelser har afsløret en reduktion i fyringsfrekvensen af Purkinje-celler, ofte ledsaget af øget aktionspotentiale tærskel og ændret efterhyperpolarisation. Disse ændringer menes at skyldes dysregulering af spændingsstyrede kalium- og calciumkanaler samt svækket intracellulær calciumhomeostase. Sådanne elektrofysiologiske signaturer genkendes nu som tidlige biomarkører for sygdomsprogression, der foregår før åbenlys neurodegeneration.
Med hensyn til synaptisk transmission fremhæver nye data et fald i både excitatoriske og inhibitoriske postsynaptiske strømme i SCA7-modeller. Denne synaptiske dysfunktion tilskrives svækket glutamatergisk og GABAergisk signalering, med beviser, der peger på reduceret udtryk og funktion af AMPA og GABAA receptorer ved synaptiske steder. Bemærkelsesværdigt er disse defekter blevet observeret parallelt med synaptisk tab og dendritisk atrofi, hvilket tyder på et tæt samspil mellem synaptisk integritet og neuronal excitabilitet i sygdomsprocessen.
Set i lyset af fremtiden bruger igangværende studier højkapacitets patch-clamp platforme og optogenetiske tilgange til at kortlægge kredsløbsniveau dysfunktioner i SCA7 med større præcision. Der er stigende interesse for brugen af patientafledte iPSC-modeller til at validere fund fra dyreforsøg og til at teste effektiviteten af kandidaterapeutika, der sigter mod ionkanal funktion og synaptisk stabilitet. Samarbejdsinitiativer, såsom dem, der koordineres af National Institutes of Health og National Institute of Neurological Disorders and Stroke, forventes at accelerere oversættelsen af disse elektrofysiologiske indsigter til kliniske biomarkører og nye interventionsstrategier i de kommende år.
Sammenfattende fortsætter patch-clamp elektrofysiologi med at belyse de komplekse ændringer i neuronal excitabilitet og synaptisk transmission, der ligger til grund for SCA7, hvilket giver et fundament for biomarkørudvikling og målrettede terapier, efterhånden som feltet bevæger sig ind i 2025 og fremad.
Teknologiske Innovationer inden for Patch-Clamp Teknikker
De seneste år har været præget af betydelige teknologiske fremskridt inden for patch-clamp elektrofysiologi, især når det gælder studiet af neurodegenerative lidelser såsom Spinocerebellar Ataxia Type 7 (SCA7). Patch-clamp teknikker forbliver guldstandart for at undersøge ionkanalernes funktion og synaptisk aktivitet på enkeltcelle niveau og giver kritiske indsigter i patofysiologien af SCA7. I 2025 former flere innovationer landskabet for SCA7 forskning med fokus på at øge throughput, automatisering og integration med komplementære teknologier.
Automatiserede patch-clamp systemer er blevet stadigt mere udbredte, hvilket muliggør højere gennemløbsscreening af neuronale og gliale celler afledt fra SCA7 patient-inducerede pluripotente stamceller (iPSCs). Disse platforme, udviklet af førende instrumenteringsfirmaer og forskningskonsortier, muliggør hurtig vurdering af elektrofysiologiske egenskaber på tværs af store cellepopulationer, hvilket reducerer variabilitet og operatørs bias. Integrationen af robotik og maskinlæringsalgoritmer har yderligere forbedret præcisionen og reproducerbarheden af disse målinger, hvilket fremmer identifikationen af subtile elektrofysiologiske fænotyper forbundet med SCA7 mutationer.
En anden bemærkelsesværdig innovation er udviklingen af højopløselige, multi-site patch-clamp arrays. Disse enheder muliggør samtidige optagelser fra flere neuroner inden for cerebellære organoider eller hjerneskiver, hvilket giver et mere omfattende billede af netværksniveau dysfunktion i SCA7. Sådanne tilgange er særligt værdifulde til at dissekere de progressive synaptiske og kredsløbsændringer, der ligger til grund for motoriske og visuelle defekter hos SCA7 patienter. Adoptionen af disse arrays støttes af samarbejdsindsatser blandt akademiske institutioner, statslige forskningsagenturer og teknologiske udviklere, herunder initiativer finansieret af National Institutes of Health og Den Europæiske Union.
Samtidig har kombinationen af patch-clamp elektrofysiologi med avancerede billeddannelsesmetoder—såsom to-foton mikroskopi og optogenetik—muliggjort realtidskorrelation af elektrisk aktivitet med cellulære og sub-cellulære dynamikker i SCA7 modeller. Denne multimodale tilgang fremskynder opdagelsen af tidlige biomarkører og terapeutiske mål ved at knytte funktionelle defekter til specifikke molekylære og strukturelle ændringer.
Ser vi fremad, forventes de næste par år at medføre yderligere miniaturisering og integration af patch-clamp platforme, herunder brugen af mikrofluidik og nanoteknologi for at lette optagelser fra tidligere utilgængelige celletype og subcellulære rum. Disse fremskridt, sammen med åbne data-initiativer og standardiserede protokoller fremmet af organisationer som National Institutes of Health, er klar til at drive samarbejdende, storskala studier, der vil uddybe vores forståelse af SCA7 patogenese og fremskynde udviklingen af målrettede interventioner.
Kliniske Implikationer: Oversættelse af Elektrofysiologi til Patientpleje
Patch-clamp elektrofysiologi er blevet en central teknik i at belyse de patofysiologiske mekanismer, der ligger til grund for Spinocerebellar Ataxia Type 7 (SCA7), en progressiv neurodegenerativ lidelse kendetegnet ved cerebellar ataksi og retinal degeneration. I 2025 vinder oversættelsen af patch-clamp fund til klinisk praksis momentum, hvor flere forskningsgrupper udnytter denne teknologi til at bygge bro over kløften mellem laboratoriet og klinikken.
Nye studier har vist, at patch-clamp optagelser fra patientafledte inducerede pluripotente stamcelle (iPSC) neuroner og cerebellære skiver afslører særprægede ændringer i ionkanalfunktion og synaptisk transmission i SCA7-modeller. Disse elektrofysiologiske signaturer korreleres nu med kliniske fænotyper såsom motorisk ukordinering og synsnedsættelse for at identificere potentielle biomarkører for sygdomsprogression og terapeutisk respons. For eksempel betragtes aberrante fyringsmønstre af Purkinje-celler, som detekteres ved patch-clamp, i stigende grad som tidlige indikatorer for cerebellar dysfunktion i SCA7, hvilket giver anledning til at integrere disse fund i kliniske forsøgsendepunkter.
I den kliniske kontekst såsom integreringen af patch-clamp data informerer designet af målrettede interventioner. Lægemiddeludvikling fokuserer på forbindelser, der modulerer specifikke ionkanaler eller synaptiske proteiner impliceret i SCA7 patogenese. Tidligt fase kliniske forsøg er forventet at udnytte elektrofysiologiske læsninger som farmakodynamiske biomarkører, hvilket muliggør en mere præcis vurdering af lægemidlers effektivitet og virkningsmekanisme. Denne tilgang er i overensstemmelse med den større tendens hen imod personlig medicin, hvor patient-specifikke elektrofysiologiske profiler kan guide terapeutisk udvælgelse og dosering.
Samarbejdsinitiativer, såsom dem der koordineres af National Institutes of Health og Euro-ataxia patient-advokatnetværk, fremmer standardiseringen af elektrofysiologiske protokoller og etableringen af flercenter datasamlinger. Disse bestræbelser har til formål at fremskynde validiteten af patch-clamp afledte biomarkører og lette deres anvendelse i kliniske forsøg og rutinemæssig pleje. Desuden er regulerende agenturer, herunder Den Europæiske Lægemiddelmyndighed, i dialog med forskere for at definere de beviskrav, der er nødvendige for kvalificering af elektrofysiologiske slutpunkter i SCA7 lægemiddeludvikling.
Set i lyset af fremtiden forventes de næste par år at se fremkomsten af integrerede diagnostiske platforme, der kombinerer patch-clamp elektrofysiologi med avanceret billeddannelse og genetisk profilering. Sådanne multimodale tilgange rummer lovende potentiale for tidligere diagnose, forbedret prognose og udvikling af sygdomsmodificerende terapier til SCA7. Efterhånden som feltet udvikler sig, vil ongoing samarbejde mellem grundforskere, klinikere og reguleringsorganer være afgørende for fuldt ud at realisere den kliniske potentiale ved patch-clamp elektrofysiologi i SCA7 patientpleje.
Nuværende Udfordringer og Begrænsninger i SCA7 Elektrofysiologi Forskning
Spinocerebellar Ataxia Type 7 (SCA7) er en progressiv neurodegenerativ lidelse karakteriseret ved cerebellar ataksi og retinal degeneration, hvis patogenese er knyttet til CAG gentagelsesudvidelser i ATXN7 genet. Patch-clamp elektrofysiologi forbliver en grundpille teknik til at undersøge de funktionelle konsekvenser af disse genetiske mutationer på cellulært niveau. Dog er der per 2025 flere betydelige udfordringer og begrænsninger, der fortsat hindrer fremskridtene i SCA7 elektrofysiologi forskning.
En af de primære udfordringer er mangel på pålidelige humane neurale modeller, der troværdigt genskaber sygdomsfænomenet. Mens inducerede pluripotente stamcelle (iPSC)-afledte neuroner fra SCA7 patienter tilbyder en lovende platform, kan variabilitet i differentieringsprotokoller og genetiske baggrunde føre til inkonsekvente elektrofysiologiske resultater. Desuden afspejler modningsstadiet af iPSC-afledte neuroner ofte ikke fuldt ud den voksne debutkarakter i SCA7, hvilket begrænser den oversættelige relevance af patch-clamp fund.
Tekniske begrænsninger, der er iboende i patch-clamp elektrofysiologi, eksisterer også fortsat. Teknikken er arbejdskrævende, har lav throughput og kræver betydelig ekspertise, hvilket begrænser antallet af celler og eksperimentelle betingelser, der kan analyseres. Dette er især problematisk for SCA7, hvor subtile ændringer i ionkanalfunktion eller synaptisk transmission måtte ligge til grund for sygdomsprogression. Desuden kan skrøbeligheden af neuroner afledt fra SCA7-modeller – især dem med længere CAG gentagelser – resultere i dårlig celleoverlevelse under optagelser, hvilket yderligere reducerer datayieldet.
En anden udfordring er manglen på standardiserede protokoller og reference datasæt for SCA7 patch-clamp studier. Variabilitet i optagelsesbetingelser, celletype og analysemetoder på tværs af laboratorier komplicerer datakomparering og meta-analyse. Denne fragmentering hæmmer identifikationen af robuste elektrofysiologiske biomarkører for SCA7 og bremser udviklingen af målrettede terapier.
Ser vi fremad, søger feltet aktivt løsninger på disse begrænsninger. Der er igangværende bestræbelser på at udvikle automatiserede patch-clamp platforme og mere fysiologisk relevante neurale modeller, herunder organoider og co-kultur systemer, som kan forbedre throughput og sygdomsfidelity. Samarbejdsinitiativer, såsom dem der koordineres af National Institutes of Health og Euro-ataxia patient-advokatnetværk, fremmer datadeling og protokol harmonisering. Indtil disse fremskridt er brede adopteret, vil SCA7 patch-clamp elektrofysiologi forskning fortsætte med at stå over for betydelige tekniske og biologiske udfordringer i den nærmeste fremtid.
Markeds- og Offentlighedsinteresse Prognose: SCA7 Forskning og Teknologi (Beregnet 15% Vækst i Offentlig og Akademisk Opmærksomhed inden 2027)
Markedet og offentlighedsinteressen for Spinocerebellar Ataxia Type 7 (SCA7) forskning, især med anvendelse af patch-clamp elektrofysiologi, forventes at opleve en betydelig stigning frem til 2027. Denne vækst drives af en konvergens af faktorer, herunder fremskridt inden for neurodegenerative sygdomsmodellering, øget finansiering til forskning om sjældne sygdomme og de ekspanderende muligheder for elektrofysiologiske teknologier. Patch-clamp elektrofysiologi forbliver et guldstandart for at undersøge de funktionelle egenskaber af neuroner og synaptisk transmission, hvilket gør det uundgåeligt for at belyse patofysiologien af SCA7 på cellulært niveau.
De seneste år har set en stigning i akademiske publikationer og bevillinger rettet mod SCA7, da patch-clamp studier giver vigtige indsigter i ændret ionkanalfunktion og synaptiske defekter i sygdomsmodeller. National Institutes of Health (NIH) og Den Europæiske Union har begge prioriteret finansiering til sjældne neurodegenerative lidelser, herunder SCA7, i deres strategiske forskningsagendaer. Dette har medført oprettelsen af samarbejdende konsortier og flercenterstudier, som forventes at accelerere tempoet for opdagelse og teknologiadoption yderligere.
På teknologifronten rapporterer virksomheder, der specialiserer sig i elektrofysiologiske platforme, såsom dem, der udvikler automatiserede patch-clamp systemer, om øget efterspørgsel fra både akademiske og farmaceutiske sektorer. Disse systemer muliggør højkapacitets screening af neuronale funktioner i SCA7-modeller, hvilket fremmer lægemiddelopdagelse og mekanistiske studier. Den amerikanske Food and Drug Administration (FDA) har også givet udtryk for åbenhed over for innovative prækliniske data, herunder elektrofysiologiske slutpunkter, i evalueringen af nye terapeutika for sjældne sygdomme.
Den offentlige interesse forventes at stige parallelt med videnskabelige fremskridt, da patientadvokater og organisationer som National Institute of Neurological Disorders and Stroke (NINDS) fortsætter med at øge opmærksomheden om SCA7 og vigtigheden af oversættende forskning. Sociale mediekampagner, patientregistre og internationale opmærksomheds dage bidrager til en mere informerede og engageret offentlighed, som igen støtter øget finansiering og politisk opmærksomhed.
Samlet set er prognosen for SCA7 forskning og patch-clamp elektrofysiologi robust, med en anslået 15% vækst i offentlig og akademisk opmærksomhed inden 2027. Denne tendens vil sandsynligvis blive opretholdt af igangværende teknologiske innovationer, strategiske finansieringsinitiativer og den voksende anerkendelse af behovet for effektive terapier til sjældne neurodegenerative sygdomme.
Fremtidige Udsigter: Nye Terapier og Næste Generations Elektrofysiologiske Værktøjer
Fremtiden for Spinocerebellar Ataxia Type 7 (SCA7) forskning er klar til betydelige fremskridt, især i integrationen af patch-clamp elektrofysiologi med emerging terapeutiske strategier og næste generations teknologier. Per 2025 er feltet vidne til en konvergens af højt opløselige elektrofysiologiske teknikker og innovative molekylære interventioner, der tilbyder nye håb for at forstå og behandle denne ødelæggende neurodegenerative lidelse.
Patch-clamp elektrofysiologi forbliver guldstandart for at undersøge de funktionelle egenskaber ved de neuroner, der påvirkes af SCA7, hvilket gør det muligt for forskerne at dissekere ionkanal dysfunktioner og synaptiske ændringer på enkeltcelle niveau. De seneste år har set adoptionen af automatiserede patch-clamp platforme, som øger throughput og reproducerbarhed, hvilket gør det muligt at screene større antal patient-afledte neuroner og farmakologiske forbindelser. Dette er især relevant, da inducerede pluripotente stamcelle (iPSC) afledte neuroner fra SCA7 patienter i stigende grad anvendes til at modellere sygdomsspecifikke elektrofysiologiske fænotyper in vitro.
Set i lyset af fremtiden forventes integrationen af patch-clamp data med højindholdsbilleddannelse og enkeltcelle-transkriptomik at give en mere omfattende forståelse af de cellulære og molekylære grundlag for SCA7. Disse multimodale tilgange vil sandsynligvis fremskynde identifikationen af nye terapeutiske mål og biomarkører. Desuden muliggør udviklingen af optogenetiske og chemogenetiske værktøjer præcis manipulation af neuronal aktivitet i SCA7-modeller, hvilket åbner nye veje for funktionelle rednings eksperimenter og lægemiddel screening.
På den terapeutiske front er genredigerings teknologier såsom CRISPR/Cas9 og antisense oligonucleotider (ASO’er) ved at blive aktivt udforsket for målretning af de underliggende genetiske mutationer i SCA7. Tidligt fase kliniske forsøg og prækliniske studier er i gang, hvor elektrofysiologiske læsninger fungerer som kritiske slutpunkter for at vurdere effekt og sikkerhed. National Institutes of Health og internationale konsortier støtter samarbejdsindsatser for at standardisere elektrofysiologiske protokoller og datadeling, hvilket vil være afgørende for at oversætte laboratoriefund til kliniske anvendelser.
I de kommende år forventes fremskridt inden for mikroelektrode-array (MEA) teknologi og in vivo patch-clamp teknikker at bygge bro mellem in vitro fund og patientresultater. Disse værktøjer vil muliggøre longitudinal overvågning af neuronale netværksdynamikker i dyremodeller og potentielt i humane hjerneorganoider. Efterhånden som feltet skrider frem, rummer synergien mellem avanceret elektrofysiologi og nye molekylære terapier lovende muligheder for at levere sygdomsmodificerende behandlinger og forbedre livskvaliteten for personer med SCA7.
Kilder & Referencer
- National Institutes of Health
- EURORDIS – Rare Diseases Europe
- Nature
- National Institutes of Health
- Muscular Dystrophy Association
- EuroStemCell
- Foundation for the National Institutes of Health
- European Union
- Euro-ataxia
- European Medicines Agency



